
科目:gzhx 來源: 題型:解答題

| 表1:生成氫氧化物沉淀的pH | 表2:原料價格表 | |||
| 物質(zhì) | 開始沉淀 | 沉淀完全 | 試劑 | 價格(元/噸) |
| Fe(OH)3 | 2.7 | 3.7 | a.漂液(含25.2%NaClO) | 450 |
| Fe(OH)2 | 7.6 | 9.6 | b.雙氧水(含30%H2O2) | 1500 |
| Mn(OH)2 | 8.3 | 9.8 | c.燒堿(含98%NaOH) | 2200 |
| Mg(OH)2 | 9.6 | 11.1 | d.純堿(含99.5%Na2CO3) | 800 |
科目:gzhx 來源: 題型:解答題
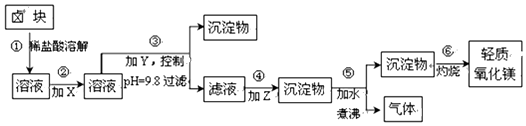
| 表1:生成氫氧化物沉淀的pH | 表2:原料價格表 | |||
| 物質(zhì) | 開始沉淀 | 沉淀完全 | 物質(zhì) | 價格(元/噸) |
| Fe(OH)3 | 2.7 | 3.7 | a.漂液(含25.2%NaClO) | 450 |
| Fe(OH)2 | 7.6 | 9.6 | b.雙氧水(含30%H2O2) | 1500 |
| Mn(OH)2 | 8.3 | 9.8 | c.燒堿(含98%NaOH) | 2200 |
| Mg(OH)2 | 9.6 | 11.1 | d.純堿(含99.5%Na2CO) | 800 |
國際學(xué)校優(yōu)選 - 練習(xí)冊列表 - 試題列表
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com