
科目:gzhx 來(lái)源: 題型:解答題
| 化學(xué)鍵 | N≡N | H-O | N-H | O=O |
| E/(kJ/mol) | 946 | 463 | 391 | 496 |
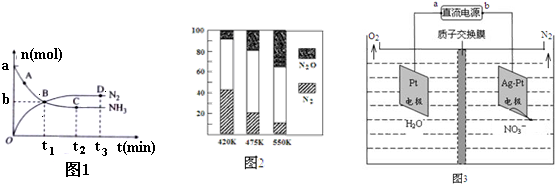
科目:gzhx 來(lái)源: 題型:解答題
| 化學(xué)鍵 | N≡N | H-O | N-H | O=O |
| E/(kJ/mol) | 946 | 463 | 391 | 496 |

科目:gzhx 來(lái)源: 題型:解答題
| 化學(xué)鍵 | N≡N | H-O | N-H | O=O |
| E/(kJ/mol) | 946 | 463 | 391 | 496 |
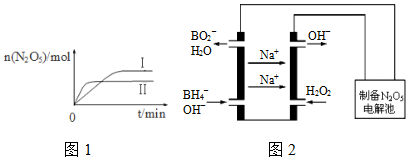
| .01mol/L 的溶液 | X | Y | Z | W |
| pH | 12 | 2 | 8.5 | 4.5 |
科目:czyw 來(lái)源: 題型:現(xiàn)代文閱讀
國(guó)際學(xué)校優(yōu)選 - 練習(xí)冊(cè)列表 - 試題列表
違法和不良信息舉報(bào)電話:027-86699610 舉報(bào)郵箱:58377363@163.com