
題目列表(包括答案和解析)
| ① | ② | ③ | ④ | ⑤ | ⑥ | |||||||||||||||
| ⑦ | ⑩ | |||||||||||||||||||
| ⑾ | ⑧ | ⑨ | ||||||||||||||||||
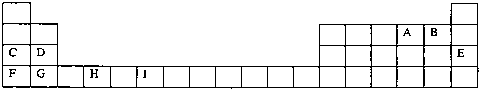
| m | n |
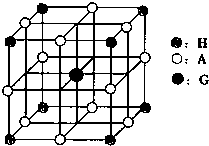
 下表是元素周期表的一部分.表中所列的字母分別代表一種化學(xué)元素.
下表是元素周期表的一部分.表中所列的字母分別代表一種化學(xué)元素.| a | b | ||||||||||||||||
| c | d | e | |||||||||||||||
| f | g | ||||||||||||||||
| M | ||
4
|
| M | ||
4
|
| A | |||||||||||||||||
| B | C | D | E | ||||||||||||||
| F | G | H | I | ||||||||||||||
| J | K | L | M | ||||||||||||||


| a | |||||||||||||||||
| b | c | d | e | f | |||||||||||||
| g | h | i | j | k | l | m | |||||||||||
| n | o | ||||||||||||||||
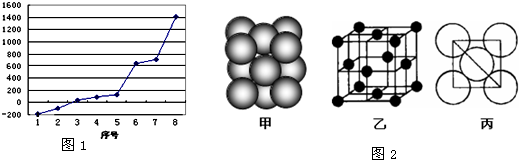


| ||
| 8NAd3 |
| ||
| 8NAd3 |
國際學(xué)校優(yōu)選 - 練習(xí)冊(cè)列表 - 試題列表
湖北省互聯(lián)網(wǎng)違法和不良信息舉報(bào)平臺(tái) | 網(wǎng)上有害信息舉報(bào)專區(qū) | 電信詐騙舉報(bào)專區(qū) | 涉歷史虛無主義有害信息舉報(bào)專區(qū) | 涉企侵權(quán)舉報(bào)專區(qū)
違法和不良信息舉報(bào)電話:027-86699610 舉報(bào)郵箱:58377363@163.com